Tedavi Süreci
Hem selim hem de habis kas-iskelet sistemi tümörlerinin büyük kısmı için ana tedavi yöntemi, tümörün cerrahi olarak çıkarılmasıdır. Kemoterapi ve radyoterapi, tümörün duyarlı olduğu durumlarda, cerrahi tedaviyi tamamlayıcı rol oynar. Bazı tümörlerin kemoterapi ve radyoterapi duyarlılığı yoktur ve cerrahi tek seçenektir. Tümörün davranış şekli, evresi, boyutları, anatomik yerleşimi ve komşuluk ilişkileri, (varsa) daha önceki tedavilere verdiği yanıt, hastanın beklentileri ve genel sağlık durumu, psikososyal faktörler ve tedavi yöntemine özgü olası komplikasyonlar ve planlı kayıplar, tedavinin şeklini belirler. Tümörün evresine göre cerrahi tedavi yaklaşımı, yukarıda “Tedavi Öncesi Evreleme” kısmında özetlenmiştir.
Habis kas-iskelet sistemi tümörlerinde tedavi süreci, ortopedik onkolog, radyolog, patolog, medikal onkolog, radyasyon onkoloğu ve pediatrik onkolog başta olmak üzere değişik branşlardan uzmanların oluşturduğu “multidisipliner” bir ekip tarafından yönetilir. Ekip, ortopedik onkolog tarafından koordine edilir. Cerrahi tedavinin özelliğine göre plastik cerrahi, göğüs cerrahisi, damar cerrahisi, genel cerrahi ve üroloji gibi diğer cerrahi branşlardan destek alınabilir. İyileşme sürecinde ise hem fiziksel hem de psikolojik rehabilitasyon için ilgili klinik branşlarla kooperasyon gerekir.
Cerrahideki temel kural sarkomlu doku ve bu doku ile temas etmiş tüm dokuların (biyopsi veya daha önce geçirilmiş yetersiz ameliyatlar sırasında dokunulan yerler, oluşan kan ve sıvıların dokular içinde ilerledikleri bölgeler) hiç görmeden ve dokunulmadan, sağlam dokudan oluşan güvenilir kalınlıkta bir doku ile tamamen örtülmüş olarak çıkartılmasıdır. Bu temiz ve güvenli sınıra ulaşmak için gereken tüm dokular çıkartılmalı, uzvun bütünlüğü, canlılığı ve işlevi için gerekli dokuların bu amaçla kaybı söz konusu olsa bile bundan kaçınılmamalı, daha sonra bunlar çeşitli yöntemlerle yeniden yapısal ve işlevsel olarak tamir ve restore edilmelidir. Uzvun yeniden kullanılabilmesini sağlayacak rekonstrüksiyon (yeniden yapılandırma) işlemi çoğu zaman ileri derecede tecrübe, beceri, gelişmiş teknoloji ve özel alanlarda (mikrocerrahi gibi) yetişmiş bir ekip gerektirir. Bu şartlar yeterince sağlanamadığı için bu işlemlerden kaçınmak, tümörün gerekli genişlikte çıkartılmasından fedakarlık etmek veya yetersiz sınırlarla yapılmış bir ameliyattan sonra tedavinin diğer yardımcı yöntemlerle (radyoterapi gibi) tamamlanmasını beklemek yapılacak en önemli hatadır. Tedaviyi yapan ekibin bilgi, beceri ve teknik donanımı bu şartları sağlayamıyorsa doğrudan uzvun feda edilmesi (amputasyon) uzvu korumak uğruna tümörün yetersiz sınırlar ile çıkartılmasına tercih edilmelidir.
Tümör dokusunun güvenli olarak vücuttan uzaklaştırılması için çıkarılması gereken doku miktarı tümör tipine ve tümör dokusunun çevresindeki dokular ile olan ilişkisine ve bu dokuların tümör dokusuna karşı oluşturdukları geçirgenlik özelliklerine göre belirlenir.
Cerrahi
Kas-iskelet sistemi tümörlerinde cerrahi tedavi, tümörün ameliyatla çıkarılması (rezeksiyon) ve tümörün yarattığı harabiyetin veya tümör çıkarılınca oluşan yapısal ve işlevsel boşluğun doldurulması (rekonstrüksiyon) işlemlerini kapsar. Cerrahi tedavi, Ortopedi ve Travmatoloji Uzmanlığı eğitimi aldıktan sonra kas-iskelet sistemi tümörleri üzerine eğitim ve deneyim kazanmış bir “Ortopedik Onkolog” tarafından uygulanır. Habis kas-iskelet sistemi tümörleri için 20. yüzyılın son çeyreğine kadar amputasyon, yani uzvun kesilmesi standart cerrahi tedavi yöntemi olarak kabul edilmekteyken günümüzde “uzuv koruyucu cerrahi” prensipleri yerleşmiş olup nadiren bir cerrahi tedavi yöntemi olarak amputasyona başvurulur. Bununla beraber habis kas-iskelet sistemi tümörlerindeki cerrahi tedavi önceliklerini şu sırayla hatırlamakta fayda vardır:
1. Önce yaşam,
2. Sonra uzuv ile yaşam,
3. Sonra işlevsel bir uzuv,
4. Sonra uzvun dış görünümü,
5. Son olarak da hastanın uygulanan cerrahi tedavi yöntemine psiko-sosyokültürel uyumu…
Cerrahi Rezeksiyon
Kas-iskelet sistemi tümörlerinin cerrahi olarak çıkartılması ile ilgili temel prensipleri anlayabilmek için öncelikle bazı teknik kavramların anlaşılması gerekir:
1. Kompartman: Doğal anatomik yapılar ile sınırlanmış kapalı bir vücut bölümüdür. örneğin her bir kas, kemik ve eklem boşluğu ayrı birer kompartmandır.
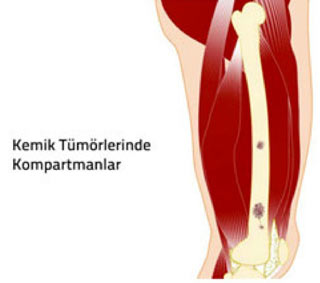
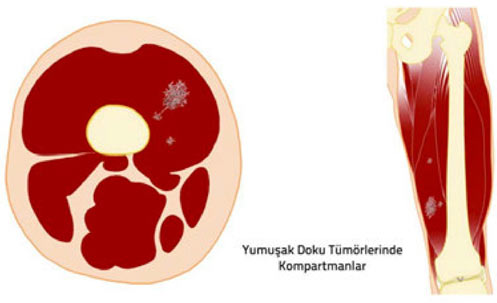
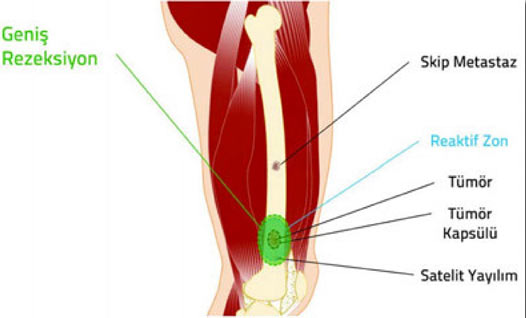
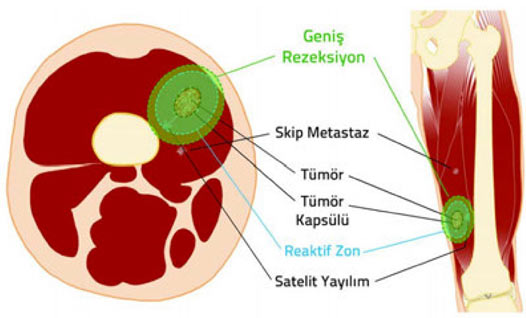
2. Kapsül: Tümör dokusu ile onu sınırlamak isteyen sağlıklı vücut dokusu arasında oluşan, tümörü çevreleyen tabaka. Habis tümörlerde kapsül hiç bulunmayabilir veya psödokapsül (yalancı kapsül) adı verilen ince bir tabaka bulunabilir. İyi huylu tümörlerin genellikle belirgin bir kapsülü vardır.
3. Reaktif zon: Habis tümörlerin çevresini saran, makroskobik olarak sağlıklı doku gibi görünse de içinde satelit lezyon adı verilen mikroskobik tümör uzantıları bulunan geçiş bölgesi.
4. Satelit yayılım: Habis tümörlerde, kapsülü delip geçerek bitki kökleri gibi yayılan ve reaktif zon içerisine yerleşen, ana tümörle doğrudan ilişkili mikroskobik uzantılar.
5. Skip metastaz: Habis tümörlerde, ana tümör ile aynı kompartman içinde bulunan, ancak tümör ile direkt bağlantısı olmayan küçük tümör odağı.
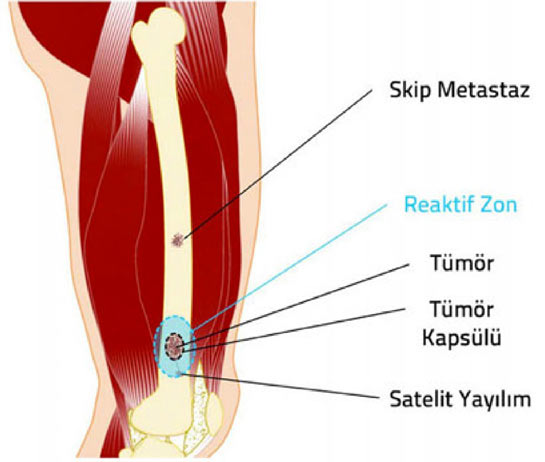
Habis kemik tümörlerinde kapsül, reaktif zon, satellit yayılım ve skip metastaz.
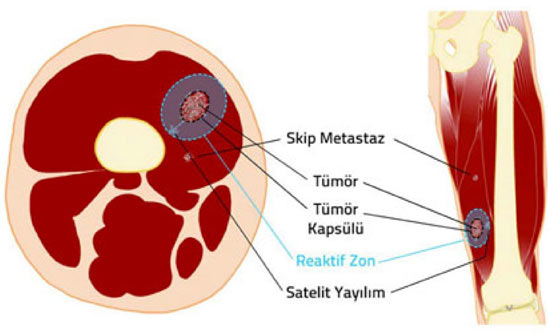
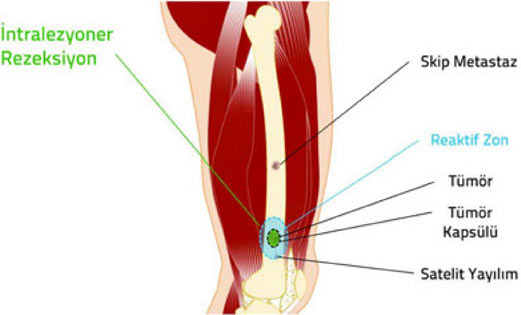
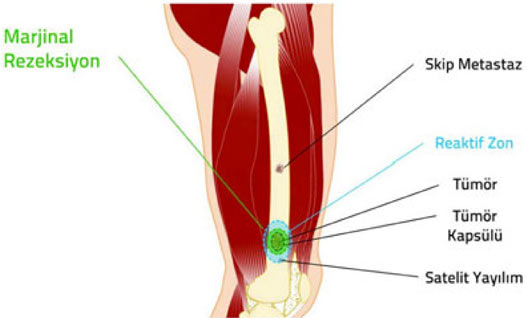
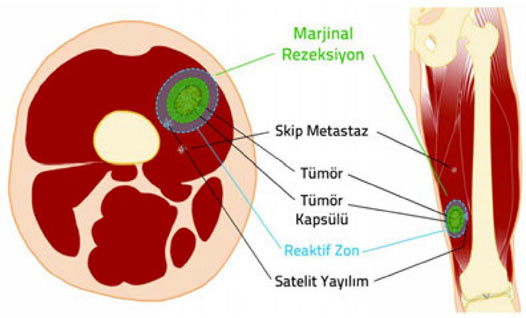
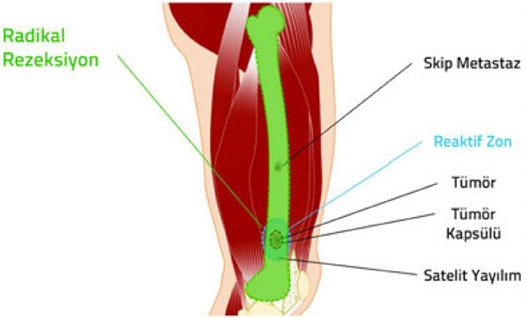
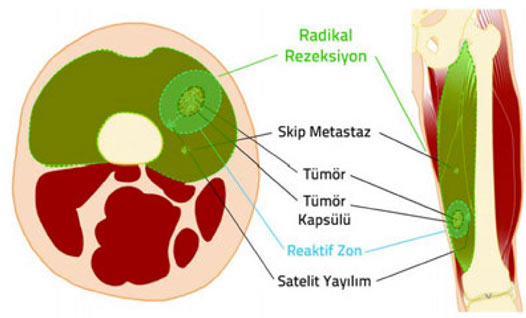
Güvenli cerrahi sınırlara ulaşmak ve gereksiz işlev kaybına yol açmamak arasındaki bu hassas denge, ortopedik onkoloğun bilgi, deneyim ve yeteneğine dayanır. Yeterli bilgi, deneyim ve yeteneğe sahip olmayan cerrahların güvenli sınırlarla uzuv koruyucu cerrahi tedavi yapması mümkün değildir.
Cerrahi Rekonstrüksiyon

Tümör, güvenli sınırlarla çıkartıldıktan sonraki aşama, kemik ve eklemlerde oluşan defektin rekonstrükte edilmesi, yani anatomik bütünlüğün sağlanarak uzvun işlevinin geri kazandırılmasıdır. Kemik tümörleri çıkartılırken yumuşak dokuda (kas, tendon, bağ, deri), ana damarlarda ve sinirlerde de kayıplar meydana gelebilmektedir. Uzvun canlılığını sürdürebilmesi ve işlev kazanabilmesi için bu yapıların da rekonstrükte edilmesi gerekebilir.
Kemik ve eklem defektleri 2 şekilde rekonstrükte edilebilir:
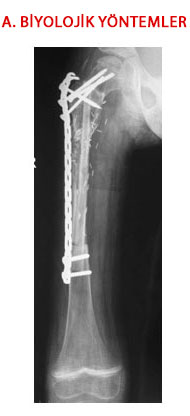
Biyolojik Rekonstrüksiyon ve Yöntemleri
Hastanın kendisinden veya başka insanlardan (bazen başka canlılardan) alınan dokularla bu eksiklikler giderilir. Amaç zaman içinde bu dokuların vücudun kalan kendi dokuları ile bütünleşerek doğal bir tamirin sağlanmasıdır. Uzun bir zaman gerektiren bu değişim süresince uzvun deforme edici etkilerden korunmasını gerektirir (koruyucu cihazlar, alçı uygulaması ve uzun süre bacağa yük vermeme gibi). Biyolojik yöntemler ile iyileşme sağlandığında vücut içinde yabancı ve cansız dokular olmadığı için bunlara bağlı reddedilme, gevşeme, aşınma ve kırılma gibi sorunlar olmayacaktır.
Biyolojik yöntemler şu şekilde gruplanabilir:
1.Kemik Nakilleri:
Hastanın kemik deposu olarak kullanılabilen bölgelerinden (en sık leğen kemiği veya bacak kemikleri) (otojen) veya başka insanlardan alınan kemik parçalarının (allojen) yardımıyla eksik bölgelerin veya boşlukların tamamlanması yöntemidir. Hastanın kendisinden damarsız olarak nakledilen kemiklerin, ya da başka insanlardan alınan kemiklerin tümünün nakledildikleri bölgede uyum süreci içinde geçirdikleri ortak bir değişim süreci vardır (creeping substitution). Nakledilen kemikler önce vücut tarafından eritilirler. Geride içi boş bir kalıp kalır. Bu arada, erime ile salgılanan maddeler vücudun kemik oluşturan hücrelerini harekete geçirirler. Bu hücreler geride kalmış kalıbın içini boş bir peteğin arılar tarafından bal ile doldurulması gibi yeni kemik oluşturarak doldururlar. Bu süreç hücresel seviyede 6 -7 sene kadar devam edebilir, ancak küçük alanlar için sıklıkla 4 – 6 ay sonunda tedavi edilen bölüm kullanılabilir hale gelir. Hastanın kendisinden alınan kemikler zaman içinde tama yakın kabul edilirken başka insanlardan nakledilenlerin bir kısmı vücut tarafından eritilebilir. Ancak bu genel olarak sonucu kötü yönde etkilemez.
Otojen Damarsız Kemik Nakli:
Nakledildikleri yerde kabul edilme oranı en yüksek olan yöntemdir.Kolay,ucuz ,emniyetli ve hazır bulunabilir olma özellikleri ile ortopedik cerrahideki en eski ve en sık uygulanan kemik kaynağıdır .Bu amaçla iliak kanat (leğen kemiği),fibula ve kaburgalar kullanılan kemiklerdir. Kaynak bölgenin sınırlı olması (özellikle çocuklarda), ikinci bir cerrahi girişim gerektirmesi gibi dezavantajları vardır.
1- Tibia üst uçta tümör
1- Tibia üst uçta tümör
İlak kanattan alınan kemikle tümör çıkartıldıktan sonra oluşan boşluk doldurulmuş.
1- Tibia üst uçta tümör
Uygulanmış kemiğin uyum göstererek boşluğu tamir ettiği görülüyor.
Otojen Damarlı Kemik Nakli:
Bütün örnekler için tıklayınız.
Hastanın vücudundaki bazı kemikler besleyici damarları ile birlikte ihtiyaç duyulan bölgeye nakledilip oradaki başka damarlara dikilirler. Bu durumda kemiğin sadece bulunduğu yer değişmiş, ancak canlılığı tamamen korunmuş olur. Yukarıda bahsedilen değişim süreci (creeping substitution) ve olabilecek negatif etkileri sözkonusu değildir.
Nakledilen kemik bulunduğu yerin yüklenme ve şekil özelliklerine göre zaman içinde değişip gelişerek oraya uyum gösterecektir. Bu avantajlarının yanında yalnızca deneyimli ve donanımlı bir cerrahi ekip (bir mikrocerrah da içeren) tarafından gerçekleştirilebilir olması, nakledilen kemiğin ancak uzun süre sonunda yük taşıyabilir hale gelmesi, bu süreç içinde o bölgenin koruması için ek tespit yöntemlerinin gerekmesi gibi dezavantajları vardır.
Allojen Damarsız Kemik Nakli:
Bütün örnekler için tıklayınız.
Organlarını bağışlayan insanların kemikleri ile gerçekleştirilir. Organ bağışçılarının üzerinde HIV, hepatit testleri ve başka testler uygulandıktan sonra alınan kemikler nakledildikleri yerde reddedilmelerine neden olacak özelliklerinin ortadan kaldırılması amacıyla bazı işlemlerden geçirilirler. Bu yöntemler arasında en sık kullanılanlar -80 dereceye kadar dondurma ve bu sıcaklıkta saklama (fresh frozen) ve bazı kimyasal yöntemlerden geçirip normal oda sıcaklığında steril paketlerde kullanıma hazır (freeze dried) olarak saklamaktır.
Hastaya ek bir cerrahi girişim gerektirmemesi ve ihtiyaç duyulan bölgeye şekil olarak uygun ve hazır olarak bulunabilir olması gibi avantajları vardır. önemli dezavantajlarından biri toplumların alışkanlıkları ve inanışlarına göre değişen elde edilebilme güçlüğüdür (örneğin ülkemizde kemik bağışı organizasyonu hala sağlanamamıştır).
önemli hastalık nakillerinin engellenebilmesi için çok dikkatli ve ciddi seçim ve hazırlık süreçleri gereklidir. Bu durum maliyeti önemli oranda artırmaktadır. Allogreftlerin uzunluğu arttıkça creeping substitution süreci uzayacak, kırılma ve kaynamama gibi sorunlarla karşılaşma olasılığı yükselecektir. Yine büyük ve ölü bir parçanın varlığı enfeksiyon riskini artıracaktır. Büyük allogreftlerin bu dezavantajları damarlı kemik nakilleri ile birlikte kullanılarak (biyolojik aktiviteyi artırma) ortadan kaldırılabilmektedir.
Yeniden Değerlendirilen Kemik (Recycled Bone):
Bütün örnekler için tıklayınız
Masif Allogreft’lerin temin güçlüğü (pahallı, ithal, zamanında bulunamama), defekte tam uyamama, düşük olasılıkda olsa hastalık nakli ve vücuda yabancı doku olma gibi dezavantajlarını içermeyen bir cins masif otogreftlerdir. Tümörlü kemik bölümü uygun sınırlarla çıkartıldıktan sonra bu kemik tümör hücrelerinin tamamen öleceği işlemlere tabi tutulur. Bunun sonucunda tüm hastalıklı hücrelerin ve bu arada diğer sağlam hücrelerin de olmuş olduğu bir kemik ortaya çıkar. Bu kemik mevcut defekte şekil ve boyut olarak tamamen uygun, hastanın kendi dokusu olduğu için hastalık nakli ve antijenik olma dezavantajlarını içermeyen, kolay ve ucuz temin edilen bir materyaldir. Yeniden değerlendirmenin bilinen uygulama yöntemleri şunlardır:
Otoklavizasyon: Otoklavda 120 derecede 20 dakika bekletme sonucu elde edilir. Kemiğin mekanik direnci ileri derecede bozulur ve protein yapıları tamamen harap olur.
Pastorizasyon
Ekstrakorporal Irradiasyon (vücut dışı ışınlama): Erken dönem için kıkırdak dokusunun korunabilir görünmesi ve mekanik yapının bozulmaması gibi avantajları vardır. Çıkartılan tümörlü parca steril olarak paketlenerek radyoterapiye gönderilir ve tek sefer 50 Gy ışınlanır. Böylece tümörlü ve diğer hücreler öldürülür. Teknik uygulama zorlukları, radyoterapi merkezi ile yakın ve koopere ilişki gerektirir. Uzun dönemde kıkırdak ve kemikte rezorpsiyon oldukça yüksek orandadır.
Sıvı azotta dondurma ve çözme: Rezektat sıvı azot tankının içinde 20 dakika bekletilerek dondurulur, ardından 15 dk. oda ısısında, 10 dk. da serum fizyolojikte bekletilerek çözülür. Mekanik ve yapısal özelliklerin en iyi korunduğu yöntemdir.
Masif Greft (Allogreft veya geri kazanılmış kemik) ve damarlı otogreft (Damarı fibula) kombinasyonu (HOT-DOG): Masif greftler mekanik olarak güçlü (avantaj) ancak biyolojik olarak cansızdırlar (dezavantaj). Vücuda uyumları ancak çok uzun süren “creeping substitution” adı verilen bir süreç ile mümkündür ve çoğu kez başarısızlıkla sonuçlanır (bakınız Biyolojik Rekonstrüksiyonun Gelişim Süreci). Damarlı fibula ise canlıdır ve normal kaynama sureci sonunda bulunduğu bölgenin parçası haline gelir (avantaj). Ancak mekanik olarak güçsüzdür ve özellikle femurda tek başına yeterli yükü taşıyamaz (dezavantaj). HOT-DOG yöntemi fibulanın (sosis), masif greftin (sandviç ekmeği) içine koyularak iki yöntemin karşılıklı olarak avantajları ile dezavantajlarının dengelendiği bir kombinasyondur.
Hot-Dog Yöntemiyle Biyolojik Rekonstrüksiyon
Biyolojik Rekonstrüksiyon Gelişim Süreci
Ortopedik onkolojide ekstremite koruyucu cerrahi serüvenimize ilk başladığımızda ilk önceliğimiz hastalarımızı güvenilir sınırlarla tümörlerinden kurtarmak oldu. Ancak kurtarılmış bir uzvun kullanılabilir hale getirilebilmesi için gereken, özellikle kemik ve eklem kayıplarının rekonstrüksyonunda elimizdeki materyalin ve teknolojik desteğin çok az olduğunu gördük. 1980’lerin başından itibaren gelişmiş ülkelerde yaygın olarak kullanılmaya başlanan mega-endoprotezlerin ne yazık ki o dönemde ülkemizde temin edilmesinin mümkün olmadığını anladık. Burada bir anımı aktarmak isterim. Onkolojık ortopedi eğitimimi tamamlayarak Viyana’dan döndüğümde ilk işim bu tür protezleri üreten firmanın temsilcisini bulmak olmuştu. Temsilciye artık benim burada olduğumu, hocam Prof.Kotz’un sözlü ve yazılı olarak üretici firmayı arayıp gerekenleri söylediğini ve onun da derhal protezleri getirmesini böylece hemen hastalarımızı tedaviye başlayabileceğimizi söyledim. Cevap şu idi: “Bunlar pahalı malzemeler, ciddi maddi yatırım gerektiriyor, üstelik siz kaç tane kullanacaksınız ki? Ben böyle bir yatırım düşünmüyorum”. Bu, onkolojik ortopedideki uzun, zorlu ama zevkli koşumun aşılması gereken hesaba katılmamış ilk engellerinden birisiydi. Sonuçta önümde tümörlerinden kurtardığımız hastalar ve yeniden kullanılabilir hale getirilmesi gereken uzuvlar vardı ve ben çözüm üretmek zorundaydım. Böylece defekt rekonstrüksiyonu için alternatif yöntem arayışına girdik. Defekt köprülemek için en kolay ulaşabildiğimiz materyalin otogreftler olduğunu farkettik ve böylece biyolojik rekonstrüksiyon serüvenimiz başlamış oldu.
Otogreftleri, özellikle fibula ve iliak kanat greftlerini, kolay ulaşılabilir olmaları, ek maliyet getirmemeleri, doku uyumu problemi ve hastalık bulaşma riski olmaması nedeniyle, o dönemden itibaren sıkça kullandık. Ancak, alınabilecek greft miktarının sınırlı olması ve verici saha problemleri nedeniyle otogreftlerinde her zaman yeterli veya en iyi çözüm olmadığını gördük.
Protez olmadığı için hareketli eklem rekonstrüksiyonu yapamadığımız durumlarda kurtarılmış uzvu kullanılabilir hale getirmek için diz artrodezlerini kullandık. Eklemin kalan karşı tarafının yarısının 180 derece döndürülerek greft olarak kullanıldığı yöntemde kaynama problemleri yaşamaktaydık. Bunun sebebi döndürülen kemik parçasının büyük masif bir greft olarak davranması ve osteointegrasyonun sağlanamaması ya da çok uzun sürmesi idi. Ancak bu yöntemle bir çok hastanın eklem hareketleri olmasa da hayatları ve uzuvları kurtarılabildi.
Büyük kemik defektlerini daha hızlı ve güvenilir şekilde köprüleme gereği ve arzusu bizi yeni yöntem arayışlarına itti. Canlı kemik nakli, yani serbest damarlı fibula grefti (SDFG) canlılığını koruyup binen yüklere göre kendini yenileyebilme ve kısa sürede kaynayabilme özellikleri ile ideale yakın çözümdü. Bu yöntemle uzun sürede kaynama ve osteointegrasyon sorunu aşılmıştı. Ancak fibula greftinin tek başına mekanik kuvveti yük taşımaya yeterli değildi, mekanik kuvveti arttırmak için ikiye katlamak ise boyunu kısaltmakta ve geniş defektlerin köprülenmesini imkansız kılmaktaydı. Başarıda en önemli nokta nakledilen kemiğin canlılığını sağlayacak damar anastomozlarını başarı ile yapabilecek ve ortaya çıkabilecek sorunları çözebilecek beceri, gayret ve özveriye sahip mikrocerrahi ekibine sahip olmaktı. Bugün en zor şartlarda başarılmış en karmaşık mikrocerrahi yöntemleri kullanarak tedavi ettiğimiz, sayı ve özellikleri ile uluslar arası değere sahip büyük bir biyolojik rekonstrüksiyon serisine sahibiz. Bu serinin oluşmasında öncelikle iki meslektaşıma teşekkür ediyorum. Birisi “Abi damarlı fibula diye bir yöntem var, gel bunu senin tümör rekonstrüksiyonlarında kullanalım” diyerek yokluk döneminde bu yöntemi getirip ilk serimizin ve deneyimlerimizin oluşmasını sağlayan Dr.Hayati Durmaz’dır. Diğeri ise plastik cerrahiden gelip “Abi ben mikrocerrahi yapmaya karar verdim, tümör rekonstrüksiyonlarına beni çağır” diyerek birlikte çalışmaya başladığımız ve birlikte bu değerli seriyi oluşturduğumuz Dr.Murat Topalan’dır. Günümüzde serbest damarlı otogreftler halen uygun lokalizasyonlarda tek başlarına (örneğin fibula grefti humerusta, iliak kanat grefti kalkaneusta) kullanılmakta ve çok iyi sonuç alınmaktadır.
Mekanik güçlülük avantajı ancak geç ve güç osteointegrasyon dezavantajı olan masif greftleri hızlı ve kolay osteointegrasyon avantajı ancak mekanik güçsüzlük dezavantajı olan damarlı fibula ile kombine etme yöntemini ilk kez diz bölgesi artrodezlerinde kullandık. Böylece geç ve güç sağlanan artrodez sorununu çözmüş olduk.
Mekanik olarak güçlü ve zaman içinde vücudun bir parçası olacak greft temini önemli sorunumuzdu. Otogreftler, özellikle çocuklarda büyük defektler için miktar ve güç olarak yetersizdi. Allogreftlerin, ülkemizde temin edilebilir hale gelmesi ile pek çok problemi çözdüğümüzü düşündük. Allogreftler, özellikle verici saha problemlerini ortadan kaldırmaktaydı ve değişik anatomik bölgelere uyan allogreftler temin etmek mümkündü. Fakat, ülkemizde organ bağışı sorununun çözülememesi ve kemik bankasının oluşturulamaması nedeniyle allogreftleri her zaman yurtdışından yüksek maliyetle temin etmek zorunda kaldık. Temin edilen masif allogreftin defekte birebir uymaması da önemli bir teknik sorun olarak karşımıza çıktı. Teorik düzeyde de olsa doku uyum sorunu ve viral hastalık bulaşma riski hep bir soru işareti olarak aklımızı kurcaladı.
Hem otogreft hem de allogreftlerle ilgili sorunlar, bizi yeni kemik kaynakları aramaya sevketti. Bu noktada bir çeşit masif otogreft olarak da düşünebileceğimiz geri kazanılmış kemik kullanımı devrim niteliğinde bir yöntem olarak karşımıza çıktı. Bu yöntemde çıkarılan tümörlü kemik, tümör hücrelerini öldürecek bir işlemden geçirildikten sonra orijinal yerine yerleştirilmekteydi. Geri kazanılmış kemiğin, şekil ve boyut olarak defekte birebir uyması, doku uyumu ve hastalık bulaşma riski bulunmaması ve ekonomik avantajı nedeniyle önceki yöntemlere göre üstündü. öte yandan tümör hücrelerinin tamamının geri kazanma işlemi sırasında öldüğünün gösterilememesi nedeniyle lokal nüks riski tartışmalı kalmaktaydı. Aynı zamanda bu teknik ile tümör hücrelerinin öldürülmesinin yanında kemik dokusunun da öldürülmesi nedeniyle kaynama potansiyeli düşmekteydi. Bir başka karşılaştığımız sorun da kemoterapi etkinliğinin değerlendirilememesi oldu.
Uyguladığımız ilk geri kazanılmış kemik yöntemi çıkartılan tümörlü kemiğin otoklavize edilerek geri yerleştirildiği yöntemdi. Ancak bu teknik kemiğin kırılgan hale gelmesi ve kaynama sorunları nedeniyle popülarize olamadı, ancak uyguladığımız vakalarda bu kemiği damarlı fibula ile kombine ederek sorunları aşabildik.
Tümörün tamamen yok edildiği ancak kemiğin mekanik gücünün kaybolmadığı yöntem arayışları bir başka seçeneği gündeme getirdi: Ekstrakorporeal irradiasyon. Bu yöntemde bir radyoterapi protokolünün tamamında verilen doz ve hatta daha fazlası (yaklaşık 50 Gy) bir defada verilmektedir. Bu şekilde eklem kıkırdağına, diğer geri kazanma yöntemlerine göre daha az zarar verdiği görüldü. Kısa zamanda yöntemin yük taşıma sorunu olmaması ve glenoid eklem kıkırdağının korunabilmesi nedeniyle özellikle skapula rezeksiyonlarında üstün bir seçenek olduğu anlaşıldı. Skapulanın geri kazanılması, tam yokluğuna göre daha üstün fonksiyonel ve kozmetik sonuç alınmasını sağladı.Ancak uzun dönemde kıkırdak dokusunun kaybı ve kemiğin ileri derecede rezorpsiyonu engellenemeyen sorunlar olarak devam etti.
Kemiğin canlı hücrelerinin ve tümörün tamamen öldürüldüğü, ancak yapısal bütünlüğünün korunduğu bir başka yöntem de sıvı azot içinde dondurma ve çözme yöntemiydi. Rezektat, 20 dakika sıvı azot içinde bekletildikten sonra 15 dakika oda havasında, 10 dakika da serum fizyolojik içinde bekletilerek çözülmesi sağlanıyor, bu sayede cansız masif bir otogreft olarak fonksiyon görüyordu. Yapısal avantajlarının yanında donan kemiğin çözülürken özellikle tümör hücre zarları parçalandığında ortaya çıkan proteinlerin, geri yerleştirme sonrasında zayıf da olsa anti-tümöral bir immün reaksiyona yol açtığı ve sistemik tedaviye katkıda bulunduğu görüldü.
Dev, strüktürel yani masif allogreftlerin protezler ile birlikte uygulanması ile kompozit biyolojik rekonstrüksiyonlar denenen yöntemler arasındadır. Ancak cansız, büyük bir kemiğin implant ile birlikte kullanılması enfeksiyona eğilim yaratmaktadır ve katastrofik sonuçlar doğurması nedeniyle yöntem yaygınlaşamamıştır. Enfeksiyon yada allogreftin tamamen rezorbe olması halinde debridmanların hatta implant ve allogreftin uzaklaştırılması gerekmektedir.
Masif greftlerin tek başlarına çözüm değil sorun kaynağı olacakları fikrindeyim. Bunun nedenlerini açıklamak için hayatımın her aşamasında dikkate aldığım bir temel kurala dikkat çekmek isterim. Doğanın kurallarına karşı işlemeye çalışan her sistem başarısızlığa mahkumdur. Tıp ve tedavi kuralları bence bu sistemin en fazla geçerli olduğu yerdir. Masif greftlerin başarısızlığa mahkumiyetlerini anlamaya çalışırken ortopedi ve kemik iyileşmesindeki iki klasik bilgiyi açıklamak gerekir. Osteomyelit ve Creeping Sustitution:
Osteomyelit, yani kemiğin bakteriyel enfeksiyonlarında, vücut kendisinden kaynaklanmış ancak artık kendisine ait olmayan kemik parçası ile mücadele etmektedir. Vücut bunu dışarı atmaya çalışır. Bu yüzden akıntılar oluşur. Vücut bu kadar büyük bir kemiği atamayacağı için bunun etrafını canlı kemikle sarar ve çevre canlı dokulardan izole etmeye çalışır. Bunun için sanki ipek böceğinin kozasını örmesi gibi bir koza, yada içerisindeki kemiğin cansız olduğu düşünülürse bir tabut gibi ölü kemiği çevreler (Totenlade). Vücut içerisindeki kendine rahatsızlık veren ancak atamadığı için izole etmek zorunda kaldığı ölü ile yaşamaya çalışır.
Creeping substitution: Bütün nakledilen kemikler (kendisinden yada başka insandan alınan) cansız ve vücuda yabancı cisimlerdir. Vücut bunu kendinden yapmaya çalışır. Tıpkı arı kovanına boş bal peteğini koyduğunuzda arının gözenekleri hazırlayarak içini balla doldurması gibi vücut da önce bu kemiğin içindeki canlı hücreleri uzaklaştırır ve geride bir gözenekler yapısı yani petek kalır. Bu gözenekler canlı kemik ile dolar. Bu süreç başlangıcından itibaren 6-7 sene sürer. Bunu histolojik olarak incelediğinizde 7 sene sonra bile halen orada bir şeylerin yapılıp birşeylerin yıkıldığını görürüz. Radyolojik olarak görüntü bir kaç sene sonra olay tamamlanmış gibi izlenim versede, aslında bahsedilen yapım – yıkım süreci devam eder.
Bu yöntem kısa mesafelerde, ve/veya az yük taşıyan bölgelerde zamanla vücuda kabul edilebilirlik için yeterli olabilir. Ancak mesafe uzayıp iş arttığında, yani “masif allogreftler”de, creeping substitution süreci kemiğin kullanılabilir, yük taşıyabilir canlı kemiğe dönüşebilmesi için yeterli değildir. İşte burada az önce bahsedilen vücudun osteomyelit cevabı mekanizması devreye girer. Kemik, yabancı gördüğü dokuyu uzaklaştıramaması nedeniyle aradaki boşluğu hem kendisi tamamlama, hemde yabancı dokuyu çevreleme çabasına girer. Bunu nasıl yapar: Koyduğumuz kemiğin her iki ucunda kaynama başlar, ve burada kaynama dokusunun radyolojik olarak görülmesi hatalı olarak entegrasyonun başladığını düşündürür. Oluşan kaynama dokusunun, allogreftin üzerine doğru yürümesi kaynamanın oluştuğu yönündeki düşünceleri destekler. 1,5 – 2 sene sonra radyolojik olarak tamamen kaynamanın gerçekleştiği zannedilir. Halbuki içerideki yapı üzeri çikolata ile kaplı dondurma gibidir, ince bir kemik tabakası vardır. Bu sisteme normal yük ve fonksiyonları verdiğinizde masif allogreftler ile ilgili karşılaşılan sorun baş gösterir: Ya bağlantı noktalarından, yada allogreftin cansız olmasından dolayı orta kısımdan kırık oluşur. Sonrasında bu ortadaki cansız kemiğin uzaklaştırılmadığı sürece rekonstrükte edilmesi artık mümkün olmaz.
Denenen tüm bu yöntemler bazı avantajlar getirirken, bazı alanlarda da dezavantajlarıyla geliyordu. Hem kemiğin mekanik gücünü koruyacak, biyolojisinin ve canlılığının bozulmadığı, ancak tümör dokusunun tamamen ortadan kaldırıldığı bir yöntem aranmaktaydı. Bu düşünceyle cansız ancak mekanik olarak sağlam masif allogreft yada geri kazanılmış kemik, canlı ancak mekanik olarak yetersiz SDFG ile kombine edildi. “HOT-DOG” olarak da adlandırılan yöntem hem cansız masif bir greftin tek başına kanlanma ve canlanma sorununu hem de tek başına fibulanın mekanik direnç sorununu ortadan kaldırmaktaydı. İçeriye konulan allogreft bir süre mekanik olarak yük taşıyabilir durumdadır, ancak bunun içine yerleştirilen damarlı fibula hızla kaynar, canlı kemikten dışarıdaki cansız kemiğe doğru ince kapiller damarlar ulaşır. Dolayısıyla canlı kemik haline dönüşme sadece “creeping substitution” süreci ile değil, içeriden taşınan daha fazla kan akımı ile de sağlanır. Bu yapı hızla yük taşıyabilecek hale gelir. Zamanla kalınlaşırken etrafındaki kemik ile daha kolay koopere olur. Bu kombinasyon uzun mesafelerin güçlü bir kemik ile köprülenmesini mümkün kılarak iyi bir sonuç sağlamıştır.
Sıvı azot yöntemiyle geri kazanılmış kemik ve SDFG kombinasyonu halen günümüzde kullanılmakta olan en sofistike biyolojik rekonstrüksiyon yöntemidir. Masif allogreft – SDFG kompozit greftine göre çok daha ucuzdur, temin etme problemi, doku uyumu problemi ve hastalık bulaşma riski yoktur. Defekt ile birebir uyumludur. Mekanik kuvvet olarak masif allogreft ile benzer özelliktedir. Masif allogrefte göre en büyük dezavantajı ise patolojik değerlendirmenin kısıtlı olmasıdır. Osteoindüktif ve osteokondüktif özellikleri, yani kaynama potansiyeli, diğer geri kazanma yöntemlerine göre daha üstündür. Damarlı fibula grefti ile konsolidasyon kapasitesi arttırılmıştır. Tek SDFG ile rezeksiyon sahasının tamamen köprülenemediği durumlarda çift (bilateral) SDFG ile “HOT-DOG” uygulaması mümkündür. Yakın gelecekte biyolojik rekonstrüksiyon alanında doku mühendislerinin geliştirdiği yeni yöntemlerin ağırlık kazanması olası gözüküyor. Halen devam etmekte olan pek çok pre-klinik ve klinik çalışma, defektlerin greft yerine osteoblast kültürü ve büyüme faktörleri emdirilmiş sentetik kemik taslakları ile doldurulmasını incelemektedir.
Biyolojik rekonstrüksiyon yöntemleriyle non-biyolojik yöntemlere göre uzun dönemde daha kalıcı çözümler sağlanmaktadır. Biyolojik rekonstrüksiyon komplikasyonlarının tedavisi daha az morbiditeye yol açmaktadır ve teknik açıdan daha kolaydır. Onkolojik ve fonksiyonel sonuçlar çok iyidir. Kemik tümörlerinin tedavisinde biyolojik rekonstrüksiyon tercih edilen tedavi modalitesidir. Zaman biyolojik rekonstrüksiyonda rekonstrüksiyonun ve hastanın lehine işlerken, non-biyolojik rekonstrüksiyonda komplikasyonların lehine, sağlam doku ve fonksiyonların aleyhine çalışmaktadır.
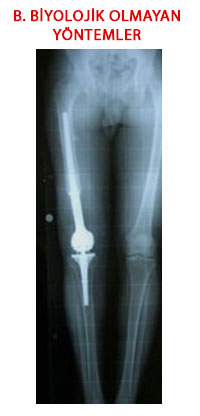
Nonbiyolojik Rekonstrüksiyon ve Yöntemleri
Tümör çıkartıldıktan sonra oluşan kemik ve eklem eksikliklerinin doğal olmayan, değişim göstermeyen ve hiçbir zaman vücudun kendi dokusuna dönüşmeyecek malzemeler kullanılarak giderilmesidir. Amaç eksikleri tamamlamanın yanında vücut bölümünün hemen kullanılabilir hale getirilmesidir. Bu malzemeler hemen bulunabilir ve günümüzdeki çeşitlilikleri sayesinde her tür boy, şekil ve bölge için mevcutturlar. Buna karşılık en önemli sorunları vücudun kendi dokusuna dönüşemedikleri için uzun dönem kullanımda canlı ve değişken doku ile bağlantı noktalarında ve kendi içlerinde gevşeme, aşınma, kırılma gibi problemlerin ortaya çıkmasıdır.
1. Kemik çimentosu:
Kimyasal olarak polimetilmetakrilat olarak isimlendirilen ve sertleştiğinde kemiğe benzer mekanik özellikleri olan, vücut tarafından kabul edilebilen bir malzemedir. Tümör cerrahisinde boşluk doldurucu ve yük taşıyıcı özelliklerinden faydalanılır. Ayrıca, sertleşirken açığa çıkan ısı yardımıyla çevesindeki tümör hücrelerini öldürme özelliği de vardır. Kalıcı olarak vücutta bırakılabileceği gibi tümör ile ilişkili sorunlar bittikten sonra çıkartılıp yerine biyolojik yöntemlerin uygulanması mümkündür.
2. Metal çivi ve Plaklar:
Biyolojik yöntemler ile kemik bütünlüğü sağlanırken mevcut sistemin şeklini korumak ve deforme edici kuvvetlerden kurtarmak amacıyla sıkça kullanılırlar. Özellikle kemik kaynamasının mümkün olamayacağı metastatik tümörlerin tedavisinde değişmeyecek ve yük taşıyabilir bir rekonstrüksiyon amacıyla kemik çimentosu ile kombine edilirler.
3.Metal Endoprotezler:
Ekstremite koruyucu cerrahi alanında çığır açan yöntemlerdir.
Protezler sayesinde eklem yüzeyleri ve ekleme komşu kemik bölümlerinin feda edildiği hastalarda hareketli bir eklem sağlanabilmektedir. Protezler çıkartılan kemik ve eklem bölümlerini taklit eden yapıda metal ve eklem yüzeylerinin esnekliğini sağlayan plastik parçalardan oluşurlar. Kemiğe kemik çimentosu ya da zaman içinde kemik ile kaynaşan özel yüzey yapılarıyla bağlanırlar.
Tümör çıkartılırken vücut yüklerini üzerine alan ve dengeli bir dağılımı sağlayan önemli adale grupları ve bağlar da çıkartılmak zorunda kalınabilmektedir. Bu nedenle tümör tedavisinde kullanılan protezler doğal eklem işleyişinden biraz daha farklı çalışırlar. Eklemde esas hareket menteşe şeklinde tek yöndedir. Başlangıçta sadece bu yönde harekete izin veren modellerde gevşeme ,aşınma ve kırılma problemlerinin fazlalığı nedeniyle bu problemleri önemli ölçüde çözen yeni modeller geliştirilmiştir. Yeni dönem protezler ilaveten kısıtlı bir dönme hareketine izin vermekte ve kemiğe çimentosuz yöntemle tesbit edilmektedirler. Ancak tüm tümör protezlerinde kemik bağlantı noktalarındaki sap bölümleri ve eklem bağlantı bölümleri anormal ve aşırı yüklenmektedir. Hastalar genelde genç, aktif ve yaşam beklentisi uzun insanlardır. Bu nedenle zaman içinde kırılma, gevşeme ve aşınmaya bağlı sorunlar ve bunların revizyonları beklenmelidir.
İlk geliştirildiklerinde kişiye özel yapıldıkları için hazır hale gelmeleri uzun bir zaman gerektirirken günümüzde omuzdan ayak bileğine kadar tüm eklem bölümlerini ve bunların birbirleri ile bağlantılarını aynı anda bir araya getirebilecek teknoloji geliştirilmiştir. Bunlar birbirine bağlanabilen değişik boylarda hazır ve her an el altında bulunabilen parçalardır.
Önemli bir sorun henüz büyüme döneminde olan hastalarda ortaya çıkmaktadır. Çıkartılan kemik ve eklem bölümü uzamayı sağlayan bölgeyi de içerdiği için ameliyat edilen bacak diğer bacağa göre zamanla kısa kalmaktadır. Büyüme tamamlandığında ortaya çıkan boy farkı kemik uzatma yöntemleri ile giderilmektedir. Bu sorunu çözmek için hem hareketli bir eklem sağlayan, hem de kısalığı engelleyici, uzatılabilen özelliği bulunan protezler kullanılmaktadır. Bunların protezin kendi içinde uzayabilen veya protezin bağlandığı kemiğin içine koyulan sap bölümü yardımıyla uzatılmasını sağlayan modelleri vardır.
Nonbiyolojik Rekonstrüksiyon Gelişim Süreci
Viyana(Avusturya)’daki; ortopedik onkoloji eğitimimi tamamlayıp İstanbul Tıp Fakültesi Ortopedi ve Travmatoloji kliniğindeki görevime geriye döndüğümde; bütün tümör vakalarının beni beklediğini, benim de her tür ameliyatı en iyi şekilde ve istediğim gibi yapabileceğimi düşünüyordum. Dünyadaki en önemli ortopedik onkologlardan birisi ve tümör protezlerindeki en büyük isim olan Prof. Kotz beni yetiştirmişti, ve üstelik Kotz tümör protezlerinin temini için ilgili firmanın merkeziyle gerekli görüşmeleri de yapmıştı. Firmanın temsilcisini çağırdım ve “ben geldim, protezleri getir ve yapmaya başlayalım” dedim. Tümör cerrahisi ile ilgili ilk gerçekle o gün karşılaştım. Temsilcinin cevabı şuydu “Siz kimsiniz, tümör protezi nedir? Anladığım kadarı ile bu pahalı bir yatırım; ben hem sizin bu ameliyatlardan; ne miktarda yapacağınızı bilemem, hem de zaten bu kadar fazla bir yatırımı düşünmüyorum!” Bu ilk şoktu. Uzuv kurtarıcı cerrahi için tümörü çıkartıyordum ama rekonstrüksiyon için protez yoktu! çözüm bulmalıydım. İmdada ilk yetişen Dr. Hayati Durmaz oldu. Mikrocerrahiye heveslenmişti ve “Abi damarlı fibula diye bir yöntem var, senin vakalarda bunu uygulayalım” dedi. Bu büyük kemik defektlerini başarı ile köprüleyerek moral bulduğumuz, ilk biyolojik rekonstrüksüyon yöntemimizdir. Bir müddet sonra plastik cerrahiden Dr. Murat Topalan geldi. O da mikrocerrahiye yönelmişti ve tümör rezeksiyonu sonrası mikrovasküler kemik ve yumuşak doku rekonstrüksüyonu yapmak istiyordu. Murat, Hayati’den bayrağı devraldı. Bugün en sıkıntılı şartlarda en karmaşık rekonstrüksüyonları başarı ile gerçekleştirebilen, çok önemli vaka serisine sahip bir ekibiz. Her iki dostumu da sevgi ve minnetle selamlıyorum.
Biyolojik rekonstrüksiyon girişimlerimize daha sonra, kemiği tümörden arındırıp yeniden kullanabilme amacıyla recycling bone (geri kazanılmış kemik) yöntemlerini de ekledik. Bu şekilde otoklavizasyon ve ekstrakorporal irradiyasyon yöntemlerini uyguladıktan sonra, 2004 tarihinde sıvı azotu kullanmaya başladık. Biyolojik rekonstrüksüyonun bugün ulaştığı en kompleks yöntem olan geri kazanılmış kemik ve içine damarlı fibula kombinasyonunu ilk kez 2005 tarihinde uyguladım. HOT DOG adı ile tanıttığım bu yöntemi başarı ile uygulamaya devam etmekteyiz.
Ancak her boşluğu kemikle dolduramıyorduk ve protez gereksinimim devam ediyordu. Bir kongrede basit ve sadece proksimal femur bölümü olan İtalyan kökenli bir protez görmüştüm. Yerli bir firma da basit menteşe eklemi yapabiliyordu. Swiss Otel’de bir kongredeydik. Arada terasta oturup çay içiyorduk. Orada ilk modüler tümör protez dizaynını çizdim. İzmir’de Hipokrat firması imalatı gerçekleştirdi. Bu şekilde ilk yerli modüler tümör protezi yapılmış oldu (1992). Bu protez gerçekten bize nefes aldırdı: 64 hastada kullandık, zamanla pek çoğu revize edildi. Benim bildiğim halen 3 hastada duruyor. Tabii ki bu sistemin eksikleri ve sorunları vardı. Ben bir taraftan protezle ilgili düzeltmeleri düşünüyor diğer taraftan da yurtdışındaki protezleri Türkiye’ye getirtmenin yollarını arıyordum. Kotz protezini getirecek firma temsilcisi halen ilgisizdi, ancak diğer firmaların ülkemize ilgisi artmakta idi. Chicago’da Dr. Finn’in geliştirdiği protez çok iyi bir alternatifti. Chicago’ya gidip Dr. Finnle bir süre çalıştım, ve uygulamaları öğrendim. Kısa bir süre sonra ilk Finn protezini uygulama zevkini tattım (17.08.1993). Bu şekilde ithal eden firmanın ekonomik nedenlerle bu işi bırakmasına kadar 38 Finn protezi uyguladık. Bu iyi bir malzeme idi, halen de birçok hastam bu protezle hayatlarını sürdürüyorlar. Diğer taraftan böyle kritik bir malzemede yurtdışına bağımlı olmanın ciddi sorunlarını erken ve geç dönemde yaşadık ve yaşıyoruz. Bugün bu malzeme artık piyasada yok ve basit bir ara parça yüzünden bazen tüm protezi değiştirmek zorunda kalıyoruz.
Bu nedenlerle yerli protezi geliştirme çalışmalarına devam ettim. İlk protezin eksiklerini düzelten, yeni kuşak yerli protezi ilk kez 07.07.1995 tarihinde uyguladım. Bu protez 1. ve 2. kuşak olarak uygulandı, daha sonra 3.kuşağını Türk Ortopedik Onkoloji Derneğinin tüm üyelerinin ortak katkıları ile hazırladık. Böylece geliştirilen ve TMTS adı verilen bu sistem pek çok merkezde önemli sayıda hastanın uzuvlarının kurtarılabilmesini sağladı. Firma temsilcisi değişmiş, bizim de tümör protezi uygulamalarımız artmıştı. Nihayet 04.09.1997 yılında ilk Kotz protezini kullandım (Viyana dönüşünden 7 yıl sonra). Bu protezi, sonradan geliştirilen rotasyonlu modeli ile birlikte toplam 45 hastamızda uyguladık. Ancak temsilci firmanın sorunları yüzünden ithalatı durdu. Ardından yeni güncel olan Mutars protezinin ülkemize gelmesini sağlayarak kullanmaya başladık. İlk uygulama 20.07.2004 tarihinde olmak üzere, toplam 57 vakada kullanıldı. Yine uzayabilen protezi ilk kez 13.04.2004’de ve toplam 5 vakada uyguladık. Ancak devletin ödeme politikası değişti, ithalat durdu. Bu arada yerli protezi üreten firma da sıkıntıya düştü ve ben başlangıçtan 20 yıl sonra yine protez temin edemez oldum.
Yabancı kökenli protezlerde ithalatçı firma sorunları, yüksek fiyat ve devletin değişen ödeme politikaları nedeniyle sürekli temin sorunu yaşanıyordu. Mevcut yerli protezin ise bir türlü düzeltilemeyen kalite ve dizaynı, son zamanlarda da üretici firmaya bağlı problemleri yeni bir yerli protez tasarımını gerektiriyordu. Böylesine bir hastalığı yenip uzuvları ile hayata adapte olmuş değerli hastalarda zamanla ortaya çıkan protez sorunları giderek artıyordu. Sadece parça değişimi ile halledilebilecek bu durumlar yurt dışına bağımlı ve artık bulunamayan parça nedeniyle tüm protezin değiştirilmesini gerektirebiliyordu. Mevcut tüm tümör protezlerini, hem de hatırı sayılır sayıda kullanmış olmak, yukarıda bahsettiğim dezavantajlar yanında bana çok değerli deneyimler de; kazandırmıştı. Bunlardan yararlanarak PENTA-MUTS’u dizayn ettim.
PENTA-MUTS (Sapların beşgen yapısı nedeniyle PENTA-Modüler Uzuv Tamir Sistemi) ilk kez 22.04.2009 tarihinde kullanıldı.Menteşe hareketi yanında rotasyona da izin veren gelişmiş eklem yapısı,çimentolu ve çimentosuz uygulanan tespit sistemi, beşgen kesit ve hidroksiappatit kaplamanın sağladığı ve en inanılmaz koşullarda başarı ile denediğimiz mükemmel stabilitesi, omuzdan dirseğe,kalçadan ayak bileğine tüm iskeleti istediğimiz gibi tamir edebileceğimiz geniş yelpazedeki modularitesi, ameliyat sırasında her parça içinde ayrı ayrı düzeltip kontrol edilebilen rotasyon ayarlanabilirliği, özel kaplamalı hafif titanyum malzemesi gibi özellikleri ile son derece gelişmiş bir protez olduğunu düşünüyorum. PENTA-MUTS; bugün primer ve komplike revizyon vakalarında başarıyla uygulanmaktadır. Böylece Viyana dönüşü yüzüme ilk çarpan güçlüğe ve ülkemizdeki tümör protezi sorununa kalıcı bir çözüm getirdiğimi düşünüyorum.
Kemoterapi
Habis tümörlerin ilaçla tedavi edilmesi yöntemidir. Yetişkin hastalara medikal onkolog tarafından tedavi uygulanır; çocuk hastalarda bu tedavi pediatrik onkolog tarafından uygulanır. Genellikle hastanede yatarak ve damardan serum ile verilir. Ancak bazı kemoterapi türleri ayaktan, yani günübirlik yatış yapılarak, veya ağızdan tablet formunda da verilebilir. Her kemoterapi dönemine “kür” veya “siklus” adı verilir. Kemoterapi ilaçları, yüksek toksisiteye sahip ilaçlardır. Bu ilaçların uygulanması sırasında bulantı-kusma, saç dökülmesi, iştah kaybı ve ishal, sık görülen yan etkilerdir. Her kür bitiminde genellikle kemik iliği hücrelerinin etkilenmesine bağlı olarak kan sayımı değerleri ciddi şekilde düşer ve hastalar enfeksiyona son derece duyarlı hale gelir. Bu dönemde hastalarda nötropenik ateş denilen tablo görülebilir ve hastanın enfeksiyondan koruma veya enfeksiyon tedavisi amacıyla hastaneye yatırılması gerekebilir. Özellikle sarkom tedavisinde, tümör üzerinde maksimum öldürücü etki sağlamak ile hastada ölümcül komplikasyonlara yol açmak arasında çok ince bir çizgi vardır. Kemoterapinin uzun vadeli etkileri ile ilgili de hastanın mutlaka onkolog tarafından bilgilendirilmesi gerekir.
Yüksek dereceli, yani hızlı büyüyen sarkomlarda genellikle ameliyat öncesinde kemoterapi uygulanır. Buna preoperatif, neoadjuvan veya indüksiyon kemoterapisi denir. En klasik örneği osteosarkom ve Ewing Sarkomu’dur. Tanı anında yapılan evrelemede akciğerler temiz görünse bile hastalığın mikrometastazlar yapmış olabileceği ka”bul edilir. Preoperatif kemoterapi ile hem ana tümör kitlesi küçültülmeye çalışılır hem de sistemik yayılımın önüne geçilmeye çalışılır. Osteosarkomda standart olarak pre- ve postoperatif 3’er kür olmak üzere 6 kür kemoterapi verilir; ameliyat öncesi ve sonrasındaki 3 kürlük dönemler genellikle 2’şer ay sürer. Ewing Sarkomu’nda ise toplam kemoterapi genellikle 1 yıl veya 13 kür sürer. İlk 4 kürden sonra tümörün yanıtı değerlendirilerek cerrahi kararı verilir veya tamamlayıcı tedavilerle devam edilir. Kemoterapi, yumuşak doku sarkomları ve kondrosarkomların, yalnızca çok yüksek dereceli veya farklılaşmamış olarak nitelenen türlerinde etkili olur.
Radyoterapi
Tümör hücrelerinin yüksek enerjili x-ışınları ile öldürülmesi işlemidir. Bu tedavi, radyasyon onkoloğu tarafından uygulanır. Genellikle ayaktan uygulanan bir tedavi yöntemidir ve her uygulama “seans” olarak adlandırılır. Radyoterapinin uygulandığı bölgeye göre farklı yan etkileri görülebilir. Halsizlik, bulantı, cilt reaksiyonları, bağırsak hareketlerinde değişiklikler sık görülen yan etkilerdir. Deneyimli bir radyasyon onkoloğu tarafından yapılmadığı takdirde dermatit denen basit cilt reaksiyonlarının ötesinde ciddi yanıklara neden olabilen bir tedavi yöntemidir. Radyoterapi, tümöral hücreleri öldürmenin yanı sıra kemik dokusu üzerinde de radyasyon nekrozu denen etkiye sahiptir ve uzun dönemde ışınlanan bölgede kırıklara yol açabilir. Çocuklardaki fiz hattı adı verilen büyüme plakları, radyoterapiden son derece olumsuz etkilenir ve bu nedenle mümkün olduğunca bu bölgelerin ışınlanmasından kaçınılır. Üreme organlarının komşuluğundaki bölgeler ışınlanacaksa gerekli cerrahi tedbirler alınmalıdır. Radyoterapinin uzun vadede ikincil sarkomlara yol açabildiği de akılda tutulmalıdır.
Tüm tehlikeli yönlerine rağmen radyoterapi, uzuv koruyucu cerrahinin çok önemli bir tamamlayıcısıdır. Ewing Sarkomu, radyoterapiye özellikle çok duyarlı olan bir tümör cinsidir. Klasik bilgilere göre osteosarkom radyoterapiye duyarsızdır. Ancak osteosarkom nükslerinde veya geniş sınırlarla rezeksiyon yapıldığı takdirde uzvu korumanın mümkün olmadığı bazı durumlarda, tümörü küçültmek, tümör küçülmüyorsa dahi marjinal sınırlarda kalırken sınır güvenliği sağlamak amacıyla kullanılabilir. Tümörün tamamen çıkarılamaz olduğu durumlarda da ağrı ve basıya bağlı şikayetleri ortadan kaldırarak geçici bir rahatlama (palyasyon) sağlamak amacıyla radyoterapi uygulanabilir. Yumuşak doku sarkomlarında da cerrahi öncesinde radyoterapi uygulaması ile sınır emniyeti arttırılabilir. Yara problemi ve ameliyat bölgesinde sıvı toplanması gibi bazı komplikasyonların görülme sıklığını arttırmakla beraber onkolojik kontrol açısından tercih edilmesi gereken bir yöntemdir.
Radyoterapi, sarkom tedavisinde çok önemli bir silah olmakla beraber, yanlış veya yetersiz bir cerrahi tedaviyi telafi edemeyeceği unutulmamalıdır.